Contenu:
◉ Introduction
La microscopie est un outil essentiel dans de nombreux domaines scientifiques, allant de la biologie cellulaire à la microbiologie, en passant par la science des matériaux. Elle permet d'observer des structures invisibles à l'œil nu, offrant des insights précieux sur la composition, la morphologie et les fonctions des micro-organismes, des cellules et des matériaux. Dans le domaine médical, l'examen microscopique est une étape clé du diagnostic des infections bactériennes, permettant de confirmer l'origine bactérienne d'une infection, d'identifier des familles de bactéries, et parfois même de détecter des pathogènes spécifiques en quelques minutes.
Cet article explore les principaux types de microscopes, leurs principes de fonctionnement, leurs applications et leurs limites.
1. Microscopie Optique
1.1 Microscope Optique à Fond Clair
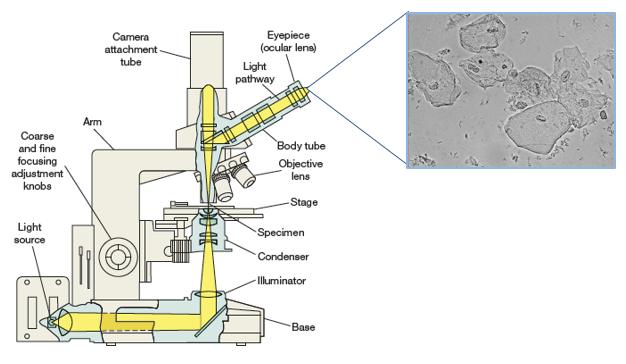
Le microscope optique à fond clair est le type de microscope le plus couramment utilisé. Il forme une image foncée sur un fond brillant, ce qui permet d'observer des échantillons colorés ou présentant un contraste naturel.
Principe :
- La lumière (provenant d'un miroir ou d'une source électrique) est concentrée sur l'échantillon par un condenseur situé sous la platine. L'objectif grossit l'objet, formant une image primaire réelle agrandie, qui est ensuite grossie par l'oculaire. Le grossissement total est le produit du grossissement de l'objectif et de l'oculaire (par exemple, un objectif x40 et un oculaire x10 donnent un grossissement de 400x).
Applications :
- Observation directe d'échantillons non colorés (état frais) entre lame et lamelle.
- Examen de la mobilité cellulaire, de la fission binaire et de la morphologie des micro-organismes.
- Utilisation d'hématimètres pour quantifier les cellules dans un volume donné.
Limites :
- Faible contraste pour les échantillons transparents.
- Nécessite souvent une coloration pour améliorer la visibilité des structures.
1.2 Microscopie Optique à Fond Noir
Le microscope à fond noir permet d'observer des échantillons transparents sans coloration, en créant un fond sombre sur lequel les structures apparaissent claires.
Principe :
- La lumière directe est bloquée, et seuls les rayons déviés par l'échantillon atteignent l'objectif. Cela crée un contraste élevé, idéal pour observer des structures fines comme les spirochètes.
Applications :
- Observation de micro-organismes mobiles, comme les tréponèmes.
- Visualisation de structures transparentes ou faiblement contrastées.
Limites :
- Ne permet pas de différencier les tréponèmes pathogènes des saprophytes.
- Requiert un opérateur expérimenté pour interpréter les résultats.

Saccharomyces cerevisiae observé au microscope à fond clair
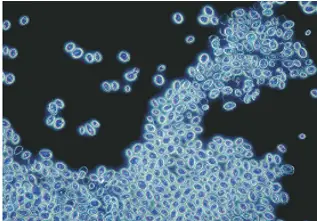
Saccharomyces cerevisiae observé au microscope à fond noir
1.3 Microscopie Optique à Contraste de Phase
Développé par Frederik Zernike dans les années 1930, le microscope à contraste de phase transforme les différences d'indices de réfraction en contrastes visibles.
Principe :
- Les différences de phase des ondes lumineuses traversant l'échantillon sont converties en variations d'intensité lumineuse. Des anneaux de phase dans le condenseur et l'objectif permettent de visualiser des structures transparentes.
Applications :
- Observation d'échantillons non colorés et non fixés.
- Étude des organites cellulaires et des structures internes des bactéries, champignons et protozoaires.
- Détection d'endospores et d'inclusions bactériennes.
Exemple :
- Clostridium botulinum avec des endospores ovales subterminales (grossissement x600).
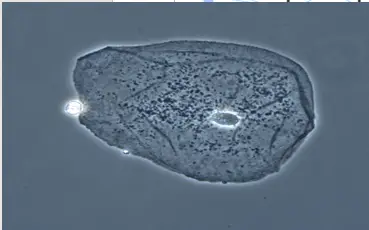
Photographie d'un cellule épithéliale vue par un Microscope à contraste de phase
Spirillum volutens en microscope à contraste de phase
1.4 Microscopie à Fluorescence
La microscopie à fluorescence exploite la propriété de certains composés (fluorochromes) à émettre de la lumière après excitation par une longueur d'onde spécifique.
Principe :
- Une source de lumière (lampe à vapeur de mercure ou LED) excite les fluorochromes, qui émettent ensuite une lumière de plus grande longueur d'onde. Des filtres séparent la lumière d'excitation de la lumière émise.
Applications :
- Coloration à l'auramine pour détecter les mycobactéries.
- Immunofluorescence pour localiser des protéines spécifiques à l'aide d'anticorps marqués.
- Étude de la dynamique cellulaire et de l'expression génique.
Avantages :
- Permet d'éliminer rapidement les frottis négatifs.
- Idéal pour les laboratoires traitant un grand nombre d'échantillon.
Limites :
- Coût élevé de l'équipement.
- Nécessite un traitement d'au moins 50 lames par jour pour être rentable.
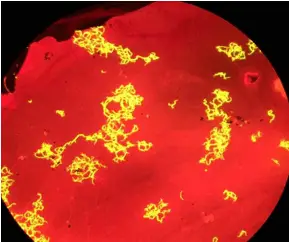
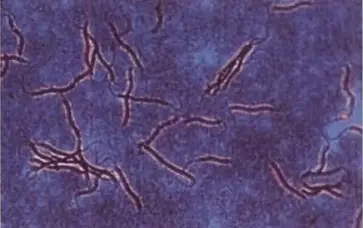
Les mycobactéries apparaissent comme des bacilles fluorescents jaune sur fond rouge
1.4 Microscopie Confocale
La microscopie confocale améliore la résolution et réduit le bruit de fond en focalisant la lumière sur un seul plan à la fois.
Principe :
- Un laser balaye l'échantillon point par point, et un diaphragme élimine la lumière hors foyer. Cela permet d'obtenir des images en 3D avec une résolution axiale élevée.
Applications :
- Imagerie 3D de cellules et de tissus.
- Étude de la localisation subcellulaire de molécules fluorescentes.
- Reconstruction d'images en volume grâce à un traitement informatique.
Avantages :
- Réduction du bruit de fond.
- Meilleure résolution spatiale.
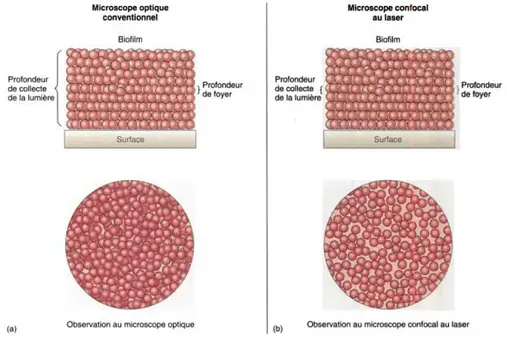
2. Microscopie Électronique
2.1 Microscope Électronique à Transmission (MET)
Le MET utilise un faisceau d'électrons pour observer des échantillons ultra-minces avec une résolution nanométrique.
Principe :
- Les électrons traversent l'échantillon et sont focalisés par des électro-aimants pour former une image sur un écran fluorescent ou une plaque photographique.
Applications :
- Observation de structures internes détaillées (organites, virus).
- Coloration négative pour visualiser des particules virales.
- Ombrage métallique pour étudier la morphologie des surfaces.
Limites :
- Préparation complexe des échantillons (coupes ultra-minces, fixation, coloration).
- Coût élevé et maintenance technique.
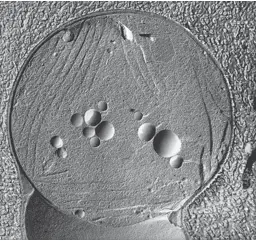
Le cyanobacterium toxique Microcystis aeruginosa (grossissement 18,000X), MET
2.2 Microscope Électronique à Balayage (MEB)
Le MEB scanne la surface des échantillons avec un faisceau d'électrons, produisant des images en 3D.
Principe :
- Les électrons sont réfléchis par la surface de l'échantillon, et un détecteur capture les signaux pour former une image.
Applications :
- Étude de la morphologie des surfaces cellulaires et des matériaux.
- Visualisation de biofilms et de structures complexes.
Avantages :
- Préparation simple des échantillons (séchage et revêtement métallique).
- Résolution élevée et images en 3D.
2.3 Microscopie à Balayage de Sonde
Cette technique inclut des microscopes comme le microscope à effet tunnel (MET) et le microscope à force atomique (MFA).
Principe :
- Une sonde balaye la surface de l'échantillon, mesurant les interactions entre la pointe et la surface pour générer une image.
Applications :
- Visualisation des atomes à la surface des matériaux.
- Étude des propriétés mécaniques et électriques des surfaces.
Avantages :
- Résolution atomique.
- Pas besoin de vide poussé (pour le MFA).
3. Techniques Émergentes
3.1 Microscopie Super-Résolution
Des techniques comme la STED (Stimulated Emission Depletion) et la PALM/STORM (Photoactivated Localization Microscopy) permettent de dépasser la limite de diffraction de la lumière, offrant une résolution à l'échelle nanométrique.
Applications :
- Étude des interactions moléculaires et de la dynamique cellulaire.
- Visualisation de structures subcellulaires avec une précision inégalée.
4. Conclusion
Les microscopes sont des outils indispensables pour explorer l'infiniment petit. Chaque type de microscope offre des avantages spécifiques, que ce soit en termes de résolution, de contraste ou d'applications. La microscopie optique reste largement utilisée pour son accessibilité et sa polyvalence, tandis que la microscopie électronique et les techniques émergentes comme la microscopie super-résolution repoussent les limites de l'observation. Ensemble, ces techniques permettent aux scientifiques de mieux comprendre le monde microscopique et de faire progresser la recherche et le diagnostic